¿QUÉ ES LA
CROMATOGRAFIA?
La cromatografía es un método
físico de separación en el que los componentes que se han de separar se
distribuyen entre dos fases, una de las cuales está en reposo (fase
estacionaria, F.E.) mientras que la otra (fase móvil, F.M.) se mueve en una
dirección definida.
Cada componente tiene un tiempo
de paso característico a través del sistema, llamado tiempo de retención. La
separación cromatográfica se logra cuando el tiempo de retención del analito
difiere del resto de componentes de la muestra.
Hay 3 métodos principales de
cromatografía: frontal, de desplazamiento y de elución. Sólo consideraremos
este último, que es el más habitual, al menos en Bioquímica y Biología
Molecular.
La
cromatografía puede ser preparativa y analítica.
· La
cromatografía preparativa se refiere a la separación de los componentes de una
mezcla para su posterior procesamiento, y se puede considerar un método de
purificación.
· En la
cromatografía analítica generalmente se hace con una pequeña muestra
permitiendo para cuantificar la proporción relativa de los componentes en la
mezcla.
Algunos de los
ejemplos en los que se usa la cromatografía a diario son:
- Se suele usar para tomar pruebas de la escena
de un crimen (el análisis de muestras de sangre o de telas - Verificación de
incendios provocados (identificación de las sustancias químicas responsables de
un fuego).
- Análisis de sangre después de la muerte o en
vida para determinar los niveles de alcohol, drogas o sustancias venenosas en
el cuerpo.
- También se utiliza para determinar la
composición de los alimentos.
- Para mirar
los niveles de contaminación, por ejemplo, del agua o del aire.
Imagen
2: ejemplo de cromatografía, recuperado de: https://www.ejemplos.co/15-ejemplos-de-cromatografia/
TIPOS DE
CROMATOGRAFIA
Dependiendo de la naturaleza de la fase
estática y de la fase móvil se pueden distinguir distintos tipos de cromatografía:
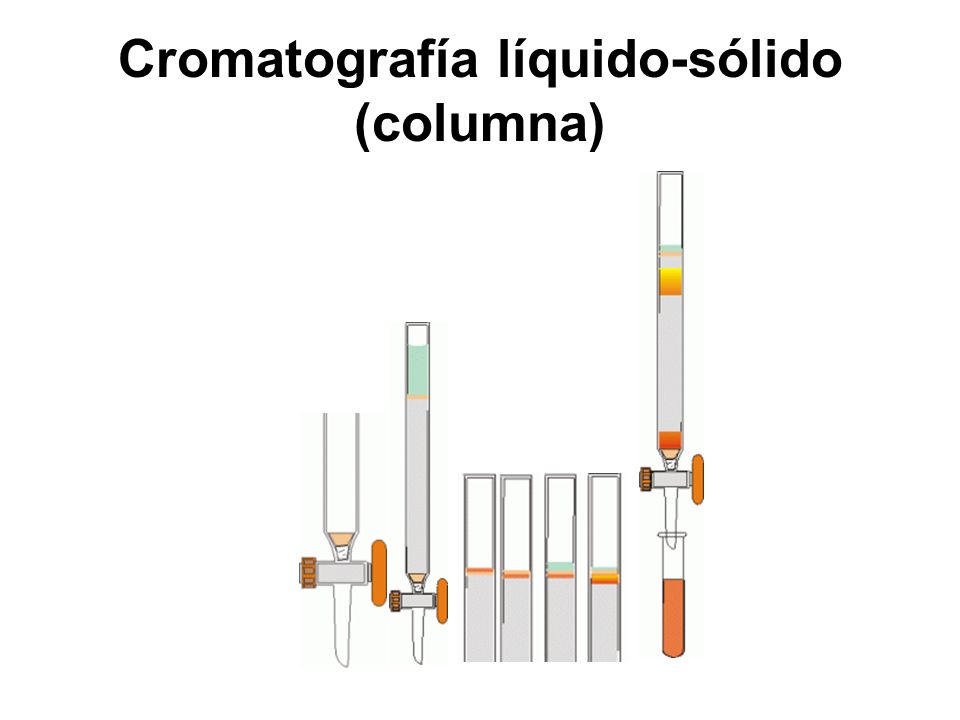
a) Cromatografía sólido-líquido: La fase
estática o estacionaria es un sólido y la móvil un líquido.
b) Cromatografía líquido-líquido: La fase
estática o estacionaria es un líquido anclado a un soporte
sólido.
c) Cromatografía líquido-gas: La fase estática
o estacionaria es un líquido no volátil impregnado en un sólido y la fase móvil
es un gas.
d) Cromatografía sólido-gas: La fase
estacionaria es un sólido y la móvil un gas.
Según
el tipo de interacción que se establece entre los componentes de la mezcla y la
fase móvil y estacionaria podemos distinguir entre.
a)
Cromatografía de adsorción: La fase
estacionaria es un sólido polar capaz de adsorber a los componentes de la
mezcla mediante interacciones de tipo polar.
Imagen 4:
Cromatografía de adsorción, recuperado de: https://unabiologaenlacocina.wordpress.com/2017/08/09/quimica-a-lo-dj-la-cromatografia-la-tecnica-analitica-mas-remasterizada/
b) Cromatografía de partición: La separación
se basa en las diferencias de solubilidad de los componentes de la mezcla en
las fases estacionaria y móvil, que son ambas líquidas.
c) Cromatografía de intercambio iónico: La
fase estacionaria es un sólido que lleva anclados grupos funcionales ionizables
cuya carga se puede intercambiar por aquellos iones presentes en la fase móvil.
BIBLIOGRAFIA:
·
Cromatografía Qué es, Fases, Tipos y Ejemplos
Sencillos. (2014, 2 junio). Recuperado 8 noviembre, 2018, de http://www.areaciencias.com/quimica/cromatografia.html
·
¿Qué es la Cromatografía?» TP - Laboratorio
Químico. (2015, 26 septiembre). Recuperado 9 noviembre, 2018, de
https://www.tplaboratorioquimico.com/laboratorio-quimico/procedimientos-basicos-de-laboratorio/que-es-la-cromatografia.html
·
Cromatografía. (2015, 6 julio). Recuperado 9
noviembre, 2018, de http://biomodel.uah.es/tecnicas/crom/inicio.htm
·
García, J. (2014, 4 febrero). 15 Ejemplos de
Cromatografía. Recuperado 9 noviembre, 2018, de
https://www.ejemplos.co/15-ejemplos-de-cromatografia/
EQUIPO 2:
Lizeth Fernández Rivera
Jessica Yislen Romero Arteaga
Julia Paula serrato Fuentes
Guadalupe Montoya
Sergio Roberto Lule
Jennifer Jasso
Hector Gonzalez Rodríguez